Kémia számítási feladatokat írni legalább olyan nehéz, mint megoldani. A szerző ügyel, hogy a feladat szövege egyértelmű legyen. Ezen felül, az igazán elegánsan megszerkesztett feladatoknál a részeredmények és a végeredmény általában egész szám, vagy legalább is könnyen kerekíthető valamilyen „szép számra”. Villányi Attila Ötösöm lesz kémiából könyve a legismertebb feladatgyűjtemény, amely teli van ilyen mesterien megírt feladatokkal. Ezen a könyvön jónéhány generáció orvos, gyógyszerész, vegyész és kémia tanár nőtt fel.
Az élet azonban néha úgy hozza, hogy hirtelen felindulásból feladatokat találjunk ki. Ekkor azonban belefuthatunk néhány érdekességbe. Nézzük csak a következő feladatot:
Számoljuk ki a következő koncentrációjú sósav pH-ját:
a) 0,01 mol/dm3
b) 1 mol/dm3
c) 2 mol/dm3
Talán meg is mosolyoghatjuk a feladatot, hiszen egyértékű erős savról van szó. Így a 0,01 mol/dm3 koncentrációjú sav pH-ja 2.
A gond a b) és a c) oldatnál kezdődik. Az 1 mol/dm3 sósav pH-ja 0, míg a 2 mol/dm3 oldat pH-ja -0,3 értékűnek adódna.
Lehet a pH érték negatív szám is?!?
Igen, lehet! Sőt, még 14-nél magasabb is. A tankönyvekben egy kicsit megtévesztő a pH skálák számozása. A zárt intervallumú skáláknál úgy tűnik, hogy a pH legkisebb értéke 0, a maximális értéke pedig 14. Pedig ez nem így van! A tömény sósav (37 w%) pH-ja -1,1 körül van, míg a tömény NaOH oldat pH-ja 15,0 körül adódik.
(Természetesen a pH = -lg[H+] egyenlet a híg savakra és lúgokra igaz, a b) és c) példánál viszont töményebb koncentrációkat hoztuk fel példának. A töményebb savaknál és lúgoknál már nem a hidrogén-ion koncentrációt, hanem az aktivitást alkalmazzuk a pH számítására.)
Kieran F. Lim a Journal of Chemical Education folyóiratban részletesen ír erről a problémáról. Úgy látszik, hogy ez a kérdés nem csupán néhány tanuló és tanár munkája során merült fel, hanem országokon átívelő téveszme. A szerző szerint a tanítás során nagyon egyszerűen tudjuk javítani a jól megszokott ábrát és ezzel a a tévképzetet is gyomlálhatjuk.
A megszokott, zárt intervallumú pH skálát korrigálva egyértelműen jellezhetjük, hogy a pH értékei egy nyílt intervallumú skálán helyezkednek el, amely nem ér véget 0 és 14 értéknél:
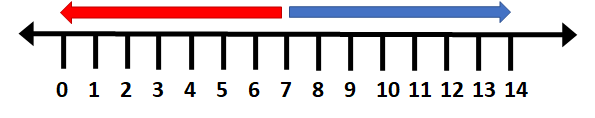
Forrás:
Keiran F. Lim. Negative pH Does Exist. J Chem Education 2006, 83(10) 1465. doi: 10.1021/ed083p1465
